
|
|
مجلة الجزيرة كما هي وكما نخطط لها
|
أما وأنَّ هذا العدد هو الرابع من "مجلة الجزيرة" التي أطلَّت عليكم دون أن يكون هناك إسناد تسويقي مسبق لصدورها..
وأنها صدرت دون كلمة عن هويتها، وبلا إفصاح عن الهدف من إصدارها فضلاً عن عدم معرفتكم ربما لما نخططه لمستقبلها..
***
في ضوء ذلك فإن عليَّ أن أسرع لأقول لكم..
لقد ملَّ القراء من الادعاء الذي تمارسه الكثير من الصحف مع كل خطوة هامشية من خطواتها..
ولا نريد للجزيرة الصحيفة أو المجلة أن تصنف ضمن منظومة هذه الصحف فيما لو قامت بمثل هذا التوجه..
***
وأننا لهذا آثرنا إصدارها دون أن يسبق ذلك ما اعتيد عليه من عمل دعائي مسبوق لمثل هذا الإصدار..
وفضلنا أن تكون المجلة بمضمونها وشكلها بمثابة الإعلان عنها والمسوق لها وأن يقتصر التنويه عن إشهارها على الأهم وفي أضيق الحدود..
ولا بأس أن أشير الآن مع صدور العدد الرابع من مجلة الجزيرة إلى:
أنَّ فكرة المجلة أن تكون منوعة ورشيقة وذات طابع علمي توثيقي..
وأن تجمع مادتها بين الجديَّة والإثارة معاً.. مع التزام بالصدق والموضوعية.. وأن يصاحب ذلك التقاط الغريب والتفتيش عن النادر والتنقيب عن الجواهر من بين هذا الكم الهائل من المواد الصحفية..
مع التأكيد على أن تكون مجلتكم جديدة في فكرتها ومواضيعها.. مختلفة عن غيرها من حيث الإخراج وتصميم الغلاف وحتى في صياغة المادة وكتابة العناوين..
وأن تبتعد مجلة الجزيرة عن القضايا والموضوعات المحلية مما هي مادة يومية مستهلكة ومكررة في صحفنا المحلية.. ومن ذلك تلك التي لا تمثل جديداً أو انفراداً للمجلة فيما لو نشرت فيها..
***
هذه بعض ملامح مجلة الجزيرة وليس كلها..
نحاول من خلال إصدارنا لها أن نرسخ قواعد وأصول المهنة...
وبالتالي تقديم أفضل خدمة صحفية لقرائنا..
ضمن تخطيط مستقبلي أفضل لهذه المجلة..
إنه هاجس الزملاء وهاجسي أيضاً..
***
وبكم..
ومعكم..
ومن أجلكم..
سيظلُّ شعارُنا:
الجزيرةُ تكفيك..
+
خالد المالك
|
|
|
|
كيف تعمل
البطاريات؟
|
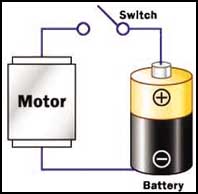
يندر أن تجد مكانا يخلو من أحد أنواع البطاريات فهي موجودة في السيارات والحاسبات الشخصية والمسجلات والهواتف الجوالة وكثير من الأجهزة والمعدات الأخرى.
فما هي هذه البطاريات بالضبط؟
البطارية في أبسط صورها علبة مملوءة بالمواد الكيماوية التي تنتج إلكترونات وتسمى التفاعلات التي تنتج عنها تلك الإلكترونات تفاعلات كيميائية كهربائية ولابد أن تحتوي أية بطارية على قطبين أحدهما موجب والآخر سالب حيث تتجمع الإلكترونات على قطب البطارية السالب وتنتقل منه إلى القطب الموجب في حالة التوصيل بينهما خارجيا بموصل "سلك" كهربائي ولكن من الخطورة الشديدة الاقتصار على ذلك الموصل دون إضافة أحمال كهربائية عليه لأن من شأن ذلك إحداث انفجار أو حريق أو على أقل تقدير تفريغ البطارية من شحنتها بشكل شبه فوري.
كيمياء البطاريات
يمكنك إجراء تجارب بسيطة في المنزل لتتعرف على التركيبات المختلفة للتفاعلات الكهربائية الكيميائية المستخدمة في تصنيع البطاريات وستحتاج من أجل ذلك إلى اقتناء جهاز بسيط لقياس الجهد والتيار الكهربائيين "فولتميتر" من أي متجر للمستلزمات الكهربائية وبسعر يسير ولكن تأكد من قدرة الجهاز الذي تستخدمه على قياس مقادير الجهد والتيار المنخفضة "في حدود 1 فولت للجهد و 5 مللي أمبير للتيار" حتى تتمكن من مراقبة ما يحدث في بطارياتك بدقة.
يمكنك البدء بمحاكاة أول بطارية عرفها العالم والتي ابتكرها رجل اسمه أليساندرو فولتا عام 1800 مستخدما طبقات مرصوصة بالتبادل من الزنك والورق النشاف المبلل بمحلول الملح والفضة شريطة أن يختلف نوع الطبقة المعدنية العليا عن تلك السفلى ويمكنك الاستعاضة عن الطبقات المعدنية بنوعين مختلفين من العملات المعدنية مع الفصل بين كل طبقة والتي تليها بمناديل ورقية مبللة بمحلول من ملح في ماء بأقصى تركيز ممكن.
قس الجهد والتيار الناتجين عن مختلف تركيبات العملات المعدنية وكذلك عن استخدام عدد مختلف من الطبقات في كل مرة كما يمكنك إجراء التجربة باستخدام معادن أخرى مثل شرائح الألومنيوم والصلب وستلاحظ أن كل تركيبة من المعادن ينتج عنها جهد مختلف عن الأخرى وإن كانت اختلافات طفيفة.
تفاعلات البطاريات
إذا تخيلت أنك غمست قضيب من الزنك في برطمان مملوء بحمض الكبريتيك فسيبدأ القضيب في التآكل مباشرة بأثر الحمض وستلاحظ تكون فقاقيع غاز الهيدروجين على الزنك وارتفاع درجة حرارة كل من القضيب والحمض وذلك كله راجع إلى تحلل جزئيات الحمض إلى أيونات هيدروجين وكبريتات من جهة وفقد ذرات الزنك بعض الإلكترونات من جهة أخرى فتتحد أيونات الزنك مع أيونات الكبريتات وتذوب كبريتات الزنك الناتجة في الحمض كما تتحد الإلكترونات التي انفلتت من ذرات الزنك مع أيونات الهيدروجين في الحمض لينشأ عن ذلك جزئيات غاز الهيدروجين التي تراه على هيئة فقاقيع على قضيب الزنك فإذا غمست قضيب من الكربون حينئذ في الحمض فلن يتأثر ولكن إذا وصلت بين قضيبا الكربون وقضيب الزنك بسلك تتدفق الإلكترونات عبره وتتحد مع الهيدروجين في قضيب الكربون مما يؤدي إلى خروج غاز الهيدروجين من قضيب الكربون على هيئة فقاقيع كما تقل درجة حرارة المجموعة ويمكن حينئذ تشغيل مصباح ضوئي أو ما شابهه باستخدام الإلكترونات المتدفقة عبر السلك وقياس جهد وتيار فيه. ومن أكثر المواد استخداما في البطاريات الحديثة الزنك مع الكربون بمعجون حمض بينهما "في الخلايا الجافة المعتادة". والزنك مع أكسيد المنجنيز في وسط قلوي "في البطاريات القلوية ذات العمر الطويل".
ترتيب البطاريات
نستخدم في معظم الأجهزة عدة بطاريات معا وفي العادة نضعها في ترتيب متسلسل للحصول على جهد أعلى أو في ترتيب متواز للحصول على تيارات أشد وتجد قيم الجهد والتيار مدونة على كل بطارية تشتريها فإذا افترضنا أن بطارية ما تعطي جهداً مقداره 25 ،1 فولت وتياراً بقوة 500 مللي أمبير ساعة فإن ذلك يعني نظريا أن البطارية تستطيع إخراج تيار شدته 500 مللي أمبير لمدة ساعة أو تيار شدته 5 مللي أمبير لمدة 100 ساعة أو تيار شدته 25 مللي أمبير لمدة 20 ساعة أوحتى 1000 مللي أمبير لمدة نصف ساعة.
إلا أن واقع الأمر يختلف عن الافتراض النظري شيئا ما لأن الوقت اللازم لحدوث التفاعلات الكيميائية داخل البطارية يفرض حدا أقصى لشدة التيار التي تستطيع إخراجه كما أن شدة التيار المرتفعة تؤدي إلى ارتفاع درجة حرارة البطارية مما يؤدي إلى فقد جانب من طاقتها إذارتبنا أربع بطاريات من النوع الذي ذكرناه في هذا المثال تسلسليا نحصل على جهد قدره 5 فولت "25 ،1x 4" بشدة تيار 500 مللي أمبير ساعة. أما إذا رتبناها على التوازي فإننا نحصل على جهد قدره 25 ،1 فولت بشدة تيار 2000 "500x 4" مللي أمبيرساعة.
هل كنت تتصور أن كل هذا يحدث داخل تلك الأشياء الصغيرة التي نستخدمها كل يوم؟
.....
الرجوع
.....
|
|
|
|

